
期刊:Nature medicine
影响因子:82.9
导语
多发性骨髓瘤(MM)是一种肿瘤性浆细胞病变,是恶性浆细胞的克隆性增殖拥有的属性。尽管已经进行了广泛的研究,但耐药患者内部和之间的疾病异质性特征不明显。在本研究中,进行单臂临床试验(nct04065789) ,结合单细胞纵向 RNA测序(scRNA-seq)来研究 MM 耐药机制的分子动力学。新诊断的 MM 患者(41例) ,在使用含硼替佐米的方案后无效或经历了早期复发,被纳入研究对象,评估达拉图姆单抗、卡非利布、来那度胺和地塞米松联合使用的安全性和有效性。通过对41例原发性难治和早期复发患者(11例健康者和15例初诊 MM 患者)的数据分析,揭示了新的 MM 分子耐受途径,包括耐缺氧、蛋白质折叠和线粒体呼吸,这些途径在临床上具有广泛的代表性。作者发现肽基脯氨酰异构酶(PPIA)是蛋白质折叠反应途径中的一个中心酶,是抗性 MM 的一个潜在的新靶点。Crispr-cas9缺失或应用小分子抑制剂(环孢素)抑制 PPIA 能显著增强 MM 肿瘤细胞对蛋白酶体抑制剂的敏感性。总之,该研究为临床试验整合 scRNA-seq 制定了路线图,确定了高耐药 MM 患者的特征,并发现 PPIA 是这些肿瘤的有效治疗靶点。
研究技术
单细胞RNA-seq(MARS-seq)
研究路线
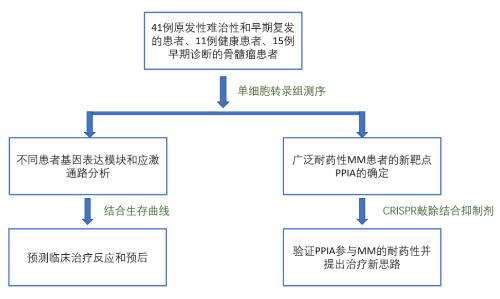
研究结果
1. NDMM和PRMM患者的转录组特征比较分析
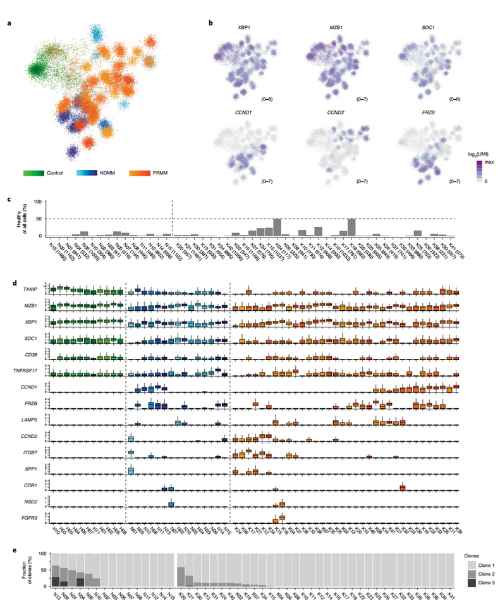
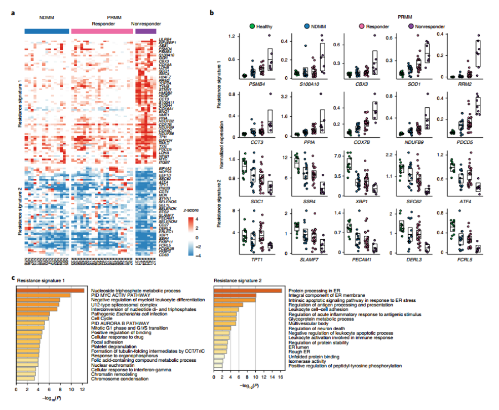
通过对受试者骨髓中的浆细胞进行单细胞RNA测序,质控后剩余51,297个细胞。作者将这些细胞划分成不同状态的细胞亚群,其中包括健康的浆细胞、NDMM患者以及治疗前和治疗后的PRMM患者(图2a)。浆细胞的标记基因如XBP1、MZB1、SDC1(CD138)和TNFRSF17(BCMA)在包括健康细胞的所有亚群中具有不同程度的表达(图2b)。此外,大多数患者中都存在一些看似健康的多克隆浆细胞,这些细胞在PRMM患者中存在更高的异质性(图2c)。单细胞转录组图谱显示,尽管每个患者都表现出独特的转录特征,但驱动基因如CCND1、CCND2和FRZB27在PRMM和NDMM患者中均有高表达,两组患者之间恶性浆细胞的驱动基因没有显著差异,因此推断这些基因并非是造成耐药性的分子因素(图2d-e)。
2. 难治性和耐药MM患者的应激通路分析
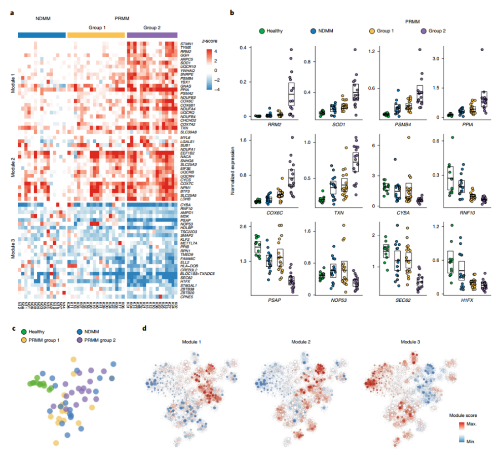
通过Bootstrapping量化了NDMM、PRMM和健康对照组之间浆细胞的基因表达,在NDMM和PRMM患者的恶性浆细胞中共鉴定出66个差异基因,它们聚类形成了3个模块,可以区分NDMM和PRMM的恶性浆细胞,并将PRMM分成group1和group2两组(图3a)。
模块1中的基因包括一些已被报道的MM高危因子,如STMN1、PSMB4、RRM2和TYMS,以及新鉴定到的基因PPIA。模块1中存在几个高度富集的特定的通路,包括线粒体应激基因COX6C、COX7A2、ER和UPR通路基因PPIA、STMN1、氧化应激基因SOD1、TXN以及蛋白酶体通路基因PSMB4和PSMA2(图3)。这些难治性和耐药MM患者具有的独特应激通路可能与MM的耐药性相关。
3. PRMM患者的特征可以预测对DARA–KRD治疗
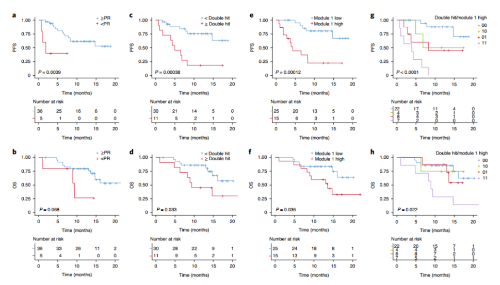
在临床试验中,41例PRMM患者接受了KYDAR药物治疗方案,这是一种高效的抗骨髓瘤四联药物方案,结果显示治疗效果在部分响应(PR)及以上的患者生存期显著延长(图4a-b)。67%的KYDAR参与者表现出高风险的细胞遗传学畸变,后续通过FISH检测评估了遗传畸变对患者预后的影响,结果显示具有大于一个畸变的患者生存期更短(图4c-d)。
分析发现了区分PRMM队列和NDMM患者的分子特征是与患者的预后相关,模块1基因表达更高的分组患者的生存期更短(图4e-f),说明这些分子特征与预后相关。综合遗传畸变和基因模块分子特征两个元素的多元模型可以更好地对药物响应情况进行预测(图4g-h)。
4. 广泛耐药MM患者的分子途径
作者比较了KYDAR治疗有应答患者和无应答患者之间的差异表达基因,发现了可以分为两个主要簇的133个差异基因,可用于区分应答患者组和无应答患者组(图5a)。这些差异基因集中在上调基因与免疫调节、蛋白酶体、凋亡和内质网应激途径,可能与耐药相关(图5b-c)。分析显示无应答患者的特征基因在很大程度上与模块1所处位置重叠,表明这两组基因集和对应患者之间存在高度重叠(图5d)。
5. PPIA是MM患者的一个新靶点,具有广泛的耐药性机制。
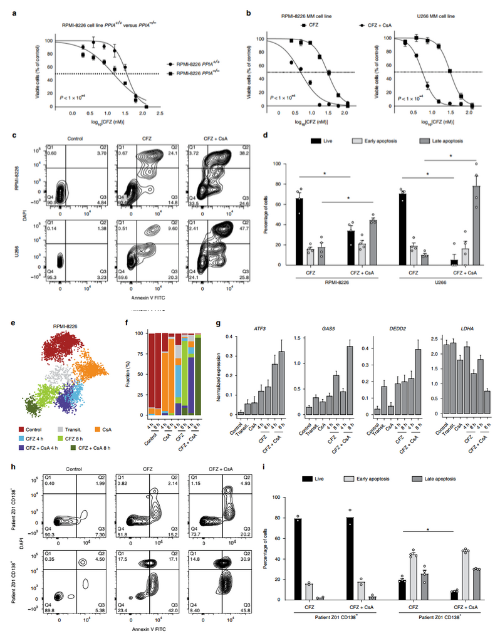
PPIA编码亲环素A(Cyclophilin A),是一种参与蛋白质折叠通路的酶。研究人员通过单细胞转录组发现PPIA在PRMM(图3a-b)和KYDAR无反应患者(图5a-b)中均存在高表达,为了验证PPIA是高耐药患者的标志物,还是作为潜在的耐药基因参与了MM耐药的分子机制,研究人员在MM恶性细胞系(RPMI- 8226)中通过CRISPR敲除了PPIA并进行了耐药实验。实验结果表明敲除PPIA或加入亲环素A的小分子抑制剂CsA,都可以提高MM细胞对蛋白酶体抑制剂CFZ的敏感性(图7a-b)。在诱导MM细胞凋亡中的作用,与CFZ或CsA单药治疗相比,联合治疗组的细胞凋亡显著增加(图7c-d)。
接下来,作者对CFZ、CsA处理后4、8小时的组合进行了scRNA-seq分析,富集得到了7个细胞亚群(图7e-f)。发现响应药物处理的细胞中与内质网应激反应(如ATF3, ATF4, BAG3)和凋亡通路相关的基因(如DEDD2, DDIT4, GAS5)表达上调,而代谢相关的管家基因(如LDHA)则发生表达下调(图7g)。与单独使用CFZ相比,CFZ+CsA联合处理的细胞基因表达水平变化更为显著,几乎所有的细胞都达到了凋亡阶段,通过MM患者恶性浆细胞进行的验证也得到了一致的结果(图7h-i),证明二者具有协同作用。进一步明确细胞对CFZ的响应和CFZ+CsA协同响应的分子机制综上所述,研究人员证明了PPIA确实参与到MM的耐药过程中,且亲环素A抑制剂可以协同克服MM细胞对于蛋白酶体抑制剂的耐药性。
总结
本文通过将单细胞转录组分析和临床试验相结合,确定了高耐药性MM患者的分子特征,发现了多项与MM患者耐药相关的机制,包括蛋白酶体机制、线粒体应激、内质网应激和蛋白质折叠通路,并找到了新的潜在药用靶点PPIA,提供了PPIA抑制剂可以和其它药物联用治疗耐药性MM的新思路。
参考文献:
Cohen Y C , Zada M , Wang S Y ,et al.Identification of resistance pathways and therapeutic targets in relapsed multiple myeloma patients through single-cell sequencing[J].Nature Medicine, 2021, 27(3).DOI:10.1038/s41591-021-01232-w.
