基本信息
货号:22661
储存条件:冰箱,避光
适用仪器:荧光显微镜
简介
肌动蛋白是一种球状的,大约42kDa的蛋白质,几乎存在于所有真核细胞中。 它也是最高度保守的蛋白质之一,在藻类和人类等多种物种中的差异不超过20%。 肌动蛋白是细胞中两种细丝的单体亚基:细丝,细胞骨架的三个主要成分之一,以及细丝,是肌细胞中收缩装置的一部分。 因此,肌动蛋白参与许多重要的细胞过程,包括肌肉收缩,细胞运动,细胞分裂和胞质分裂,囊泡和细胞器运动,细胞信号传导,以及细胞连接和细胞形状的建立和维持。
我们的Cell Navigator™荧光成像试剂盒是一套荧光成像工具,用于标记亚细胞器,如膜,溶酶体,线粒体,细胞核等。活细胞区的选择性标记为研究空间和时间细胞事件提供了一种强大的方法。
该特定试剂盒设计用于标记具有绿色荧光的固定细胞中的F-肌动蛋白。 该试剂盒使用绿色荧光鬼笔环肽缀合物,其选择性结合F-肌动蛋白。 该绿色荧光鬼笔环肽缀合物是F-肌动蛋白的高亲和力探针。 当以纳摩尔浓度使用时,phallotoxins是方便的探针,用于标记,鉴定和定量甲醛固定和透化组织切片中的F-肌动蛋白,细胞培养物或无细胞实验。 该试剂盒为所有必需组件提供优化的染色方案,该方案功能强大,只需极少的手动操作时间。 它是保存特定细胞荧光图像的绝佳工具。 鬼笔环肽缀合物具有与FITC类似的光谱性质(Ex / Em = 500 / 520nm)。 它也可以用于使用FITC滤光片(Ex / Em = 490 / 525nm)的荧光显微镜演示。
试剂盒组成

分析方案
简要总结
准备样品(微孔板孔)®
从板中取出液体®
添加100μL/孔的iFluor™488-鬼笔环肽溶液®
在室温下染色细胞15到60分钟®
洗涤细胞®
在显微镜下检查样品Ex / Em = 488 / 520nm
注意:打开前将所有组件加热至室温
详细步骤
1.准备1X iFluor™488-鬼笔环肽工作溶液:
将10μL的iFluor TM 488-鬼笔环肽(组分A)加入10mL标记缓冲液(组分B)中。
注1:未使用的1X iFluor™488-鬼笔环肽原液应等分并保存在-20ºC。避光保存。
注2:不同的细胞类型可能染色不同。 应相应地制备iFluor TM 488-鬼笔环肽工作溶液的浓度。
2.染色细胞:
2.1进行甲醛固定。 在室温下用3.0-4.0%甲醛的PBS孵育细胞10-30分钟。
注意:避免使用任何含甲醇的固定剂,因为甲醇会在固定过程中破坏肌动蛋白。优选的固定剂是不含甲醇的甲醛。
2.2用PBS冲洗固定的细胞2-3次。
2.3可选:将0.1%Triton X-100在PBS中加入固定细胞(来自步骤2.2)3至5分钟,以增加渗透性。 用PBS冲洗细胞2-3次。
2.4将100μL/孔(96孔板)的iFluor TM 488-鬼笔环肽工作溶液(来自步骤1)加入固定的细胞(来自步骤2.2或2.3),并在室温下将细胞染色15至60分钟。
2.5用PBS轻轻冲洗细胞2至3次以去除多余的染料,然后使用FITC通道进行板密封和成像。
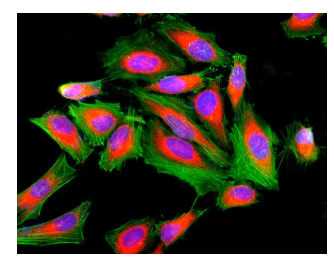
图1.用4%甲醛固定的HeLa细胞的荧光图像,然后在Costar黑色96孔板中用Cell Navigator TM FActin标记试剂盒*绿色荧光*染色。 细胞分别用iFluor TM 488-鬼笔环肽(Cat#22261,Green)和细胞核染色DAPI(Cat#17507,蓝色)标记。 在固定之前,用ER Red TM(Cat#22636,Red)染色细胞内质网(ER)。
参考文献
1. Szczesna D, Lehrer SS (1993). The binding of fluorescent phallotoxins to actin in myofibrils. J Muscle Res Cell Motil, 14(6), 594.
2. Johnson S C, Nancy M. McKenna M N, and Wang Y (1988). Association of microinjected myosin and its subfragments with myofibrils in living muscle cells. J Cell Biol, 107(6), 2213.
3. Wang K, Feramisco JR, Ash JF (1982). Fluorescent localization of contractile proteins in tissue culture cells. Methods Enzymol, 85 Pt B, 514.
4. Miki M, Barden JA, dos Remedios CG, Phillips L, Hambly BD (1987). Interaction of phalloidin with chemically modified actin. Eur J Biochem 165, 125.
5. Cooper JA. (1987). Effects of cytochalasin and phalloidin on actin. J Cell Biol 105, 1473.
