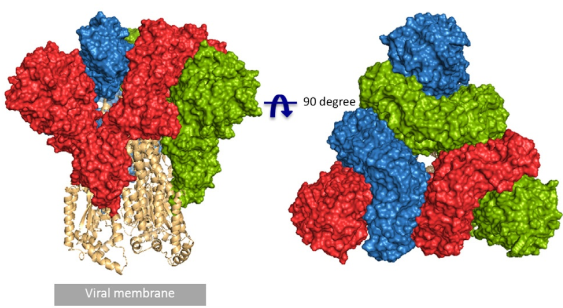
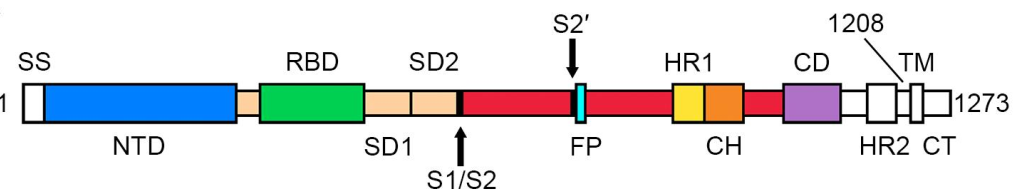
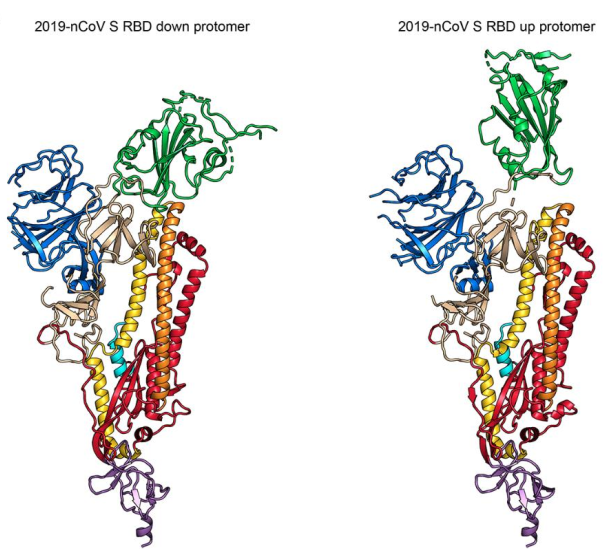
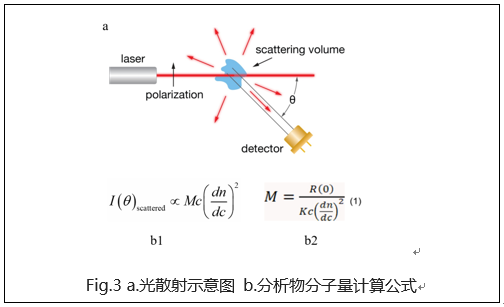
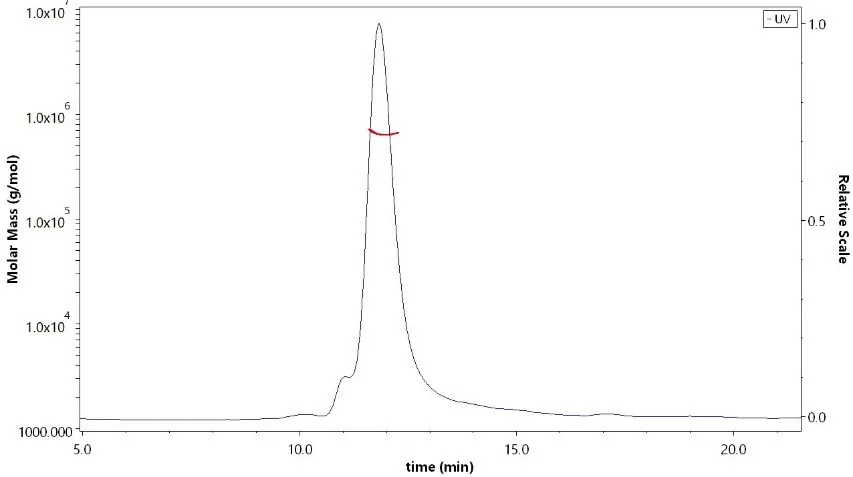
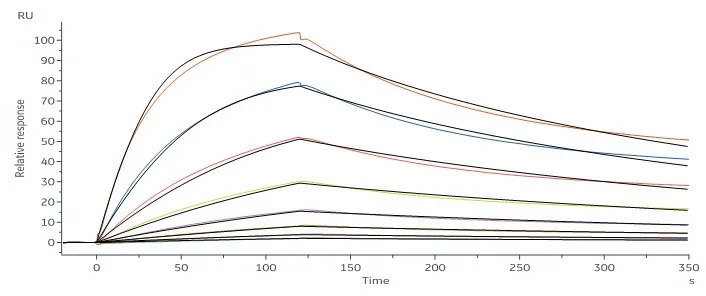
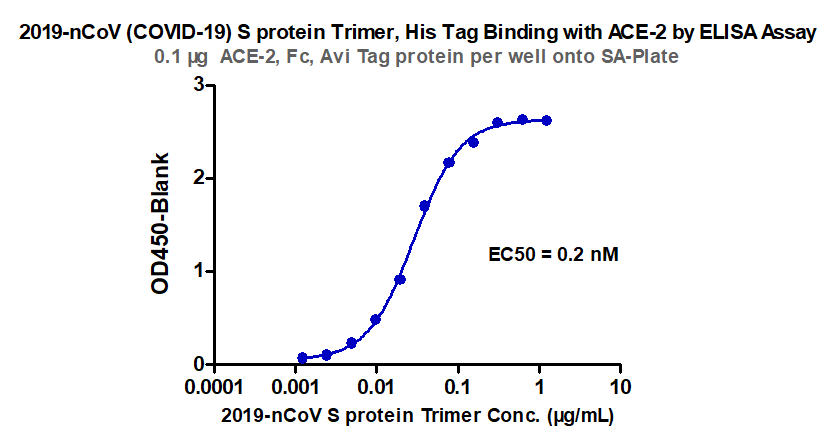
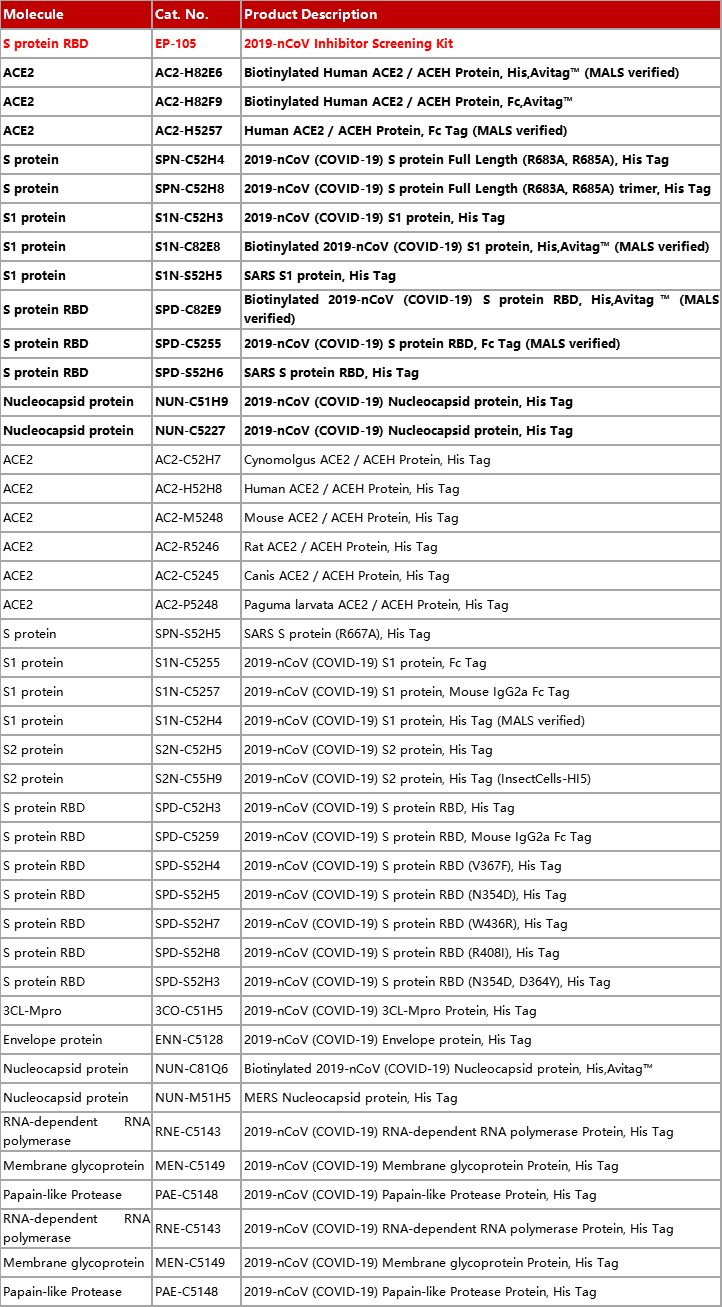
冠状病毒包含E (envelope protein)、M (membrane protein)、N (nucleocapsid protein)和S (spike protein)四种典型结构蛋白。其中,S蛋白包含S1和S2两个功能性亚基,S1负责与宿主细胞受体结合,S2负责将S蛋白锚定在病毒膜上并介导病毒膜与宿主细胞膜的融合。所以S蛋白是介导冠状病毒进入宿主细胞的主要蛋白,也是感染后引起宿主免疫系统产生中和性抗体的主要靶标。 S蛋白在冠状病毒的表面会形成突出的同型三聚体,2020年2月份Science重磅报道了2019-nCoV S蛋白三聚体的cyro-EM结构,不仅为解释2019-nCoV S蛋白与ACE2蛋白的亲和力比SARS S高10-20倍提供了结构依据,也进一步阐释了S蛋白三聚体结构对于介导冠状病毒进入宿主细胞的重要作用。与SARS-CoV和MERS-CoV S蛋白类似,2019-nCoV S蛋白三聚体结构中,每一个S蛋白单体与相邻的S蛋白相互缠绕形成紧凑的mushroom-shaped同型三聚体,其中S1亚基的SD1/SD2 domain与相邻S的S2亚基相互作用,这种相互缠绕的模式使得S1形成类似冠状的结构从而将S2 trimer锁定在prefusion的状态(如Fig.1),而S1 RBD与受体ACE2的结合以及S1/S2边界处的酶切断裂,都会使S1三聚体冠状结构移除,从而造成S2大规模的构象变化,进而导致病毒膜与宿主膜融合(Fig.2)。可以说,S蛋白的trimer结构对于稳定S2 trimer prefusion的构象至关重要,也会直接影响其与ACE2蛋白的结合活性。 Fig.1 Front and top view of the trimeric coronavirus spike protein ectodomain obtained by cryo-electron microscopy analysis. Three S1 protomers (surface presentation) are colored in red, blue, and green. The S2 trimer (cartoon presentation) is colored in light orange. Fig.2 Schematic of 2019-nCoV S primary structure(colored by domain) and A single promoter of 2019-nCoV S with the RBD in the down (left) and up conformation(right). 因此,具有正确结构的三聚体S蛋白对于抗病毒药物的开发具有重要意义,重组表达S蛋白产品在研发和生产质控过程中需要对其分子量进行准确测定,证明S蛋白在生理溶液中是以正确的天然三聚体状态存在,保证其应有的正确结构和功能。 常见的蛋白分子量测定技术有相对定量法 (SEC-HPLC,高效分子筛液相色谱) 和绝对定量法(SEC-MALS,多角度激光散射),两种技术都可以方便的测定溶液中生理条件下蛋白的分子量,但由于原理上的不同,导致检测结果准确度存在显著差异 (表1) 。SEC-HPLC需要借助标准蛋白进行分子量内插测定,实际应用中常常受到多种因素的干扰,无法准确得到蛋白质真实分子量和聚集状态。MALS技术 (Multi-Angle Light Scattering) 是基于蛋白的分子量与光散射的强度直接相关来测定蛋白绝对分子量的技术,无需使用标准蛋白,不依赖于洗脱保留时间,也就避免了SEC分子筛测定分子量的诸多问题。SEC-MALS技术中,通过SEC分离后的各组份进入多角光散射检测器,激光照射到分析物时会发生光的散射,MALS通过多个角度同时测定散射光的强度 (Fig.3a) 。从公式b1中 (Fig.3b1) 可以看出散射光强度正比于摩尔质量、浓度、折光指数增量的平方,用公式b2(Fig.3b2)可以直接计算出分析物的绝对分子量。由此可见,MALS技术不依赖于蛋白的洗脱保留时间来计算蛋白分子量,因此测定结果较传统的SEC-HPLC更加准确可靠。 表1. SEC-HPLC和SEC-MALS两种检测方法的比较 基于SEC-MALS方法的独特优势,ACROBiosystems独家推出以正确三聚体形式存在的高活性S蛋白,并使用SEC-MALS技术对蛋白的分子量和聚体形式进行了严格验证。结果显示,全长三聚体S蛋白在溶液生理条件下以正确的三聚体形式存在,且三聚体含量达到85%以上,同时,经SPR验证ACE2亲和力为35nM,ELISA中EC50为0.2nM,具有非常理想的天然活性。 天然三聚体S活性蛋白的上市,有助于更加深入地理解病毒感染机理,为快速药物筛选和药物开发提供有力的支持。 2019-nCoV (COVID-19) Full Length S protein (R683A, R685A), His Tag, active trimer (MALS verified) 全长S三聚体蛋白的纯度高于85%,经MALS验证分子量为640-680 kDa 全长三聚体S蛋白与ACE2蛋白结合活性:亲和力常数35.3 nM (SPR) Human ACE2, Fc Tag (Cat. No. AC2-H5257) Captured on CM5 chip via anti-human IgG Fc antibodies surface can bind 2019-nCoV (COVID-19) Full Length S protein (R683A, R685A), His Tag, active trimer (Cat. No. SPN-C52H8) with an affinity constant of 35.3 nM as determined in a SPR assay (Biacore 8K). 全长三聚体S蛋白与ACE2蛋白结合活性:EC50为0.2 nM (ELISA) Immobilized Biotinylated Human ACE2 / ACEH Protein, Fc, Avi tag™ (Cat. No. AC2-H82F9) at 1 μg/mL (100 μL/well) on streptavidin precoated (0.5 μg SA/well) plate, can bind 2019-nCoV (COVID-19) Full Length S protein (R683A, R685A), His Tag, active trimer (Cat. No. SPN-C52H8) with a linear range of 1-20 ng/mL. 产品列表 (2019-nCoV Inhibitor Screening Kit即将面市,敬请关注,欢迎预购! 点击下方图片可查看在线产品更多信息及预购产品预计上线时间!) >其他相关文章 >HPLC验证的2019-nCoV蛋白加速抗病毒药物的开发—ACROBiosystems >蛋白聚体,你真的分析对了么?——ACROBiosystems >生物素标记2019-nCoV蛋白加速药物的筛选和验证—ACROBiosystems >经SPR/BLI验证天然结合活性的新冠病毒蛋白上线!—ACROBiosystems 参考资料 1. Wrapp D, et al., Cryo-EM structure of the 2019-nCoV spike prefusion conformation. Science. 2020 Mar. 2. R.J.G. Hulswit, et al., Coronavirus Spike Protein and Tropism Changes. Advances in Virus Research. 2016 Aug. 3. Paula et al. A Review Size-Exclusion Chromatography for the Analysis of Protein Biotherapeutics and their Aggregates. Journal of Liquid Chromatography & Related Technologies. 2012.